研究成果
正常プリオン蛋白の機能解析
分担研究者:東京大学大学院農学生命科学研究科食の安全研究センター・佐伯圭一
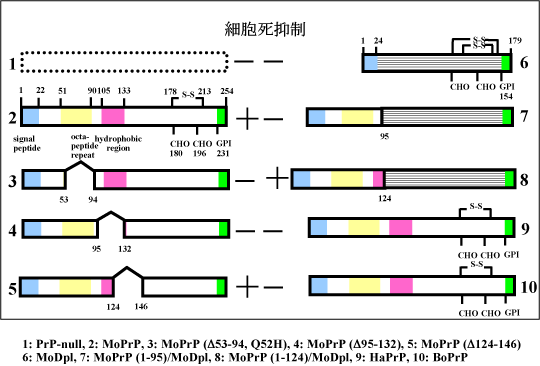
プリオン蛋白(PrP)遺伝子欠損マウス脳から樹立したPrP欠損細胞は、通常培養条件から血清を除去することにより、アポトーシス細胞死を起こす(1)。一方でマウスPrP(MoPrP)遺伝子を導入することにより、細胞死が抑制された(2)。アポトーシス抑制部位を同定するために、部分欠損遺伝子を作製し、導入するとアミノ酸領域53-94(3)および95-132(4)の欠損では細胞死抑制が認められなかったが、124-146(5)の欠損では細胞死抑制が認められた。PrP様蛋白(Dpl)遺伝子(6)およびDpl遺伝子にPrP1-95を融合させた遺伝子(7)の導入では、細胞死抑制が認められなかった。一方で、Dpl遺伝子にPrP1-124を融合させた遺伝子(8)の導入では、細胞死抑制が認められた。以上のことから、PrPによる細胞死抑制部位はN末端側の124アミノ酸領域に存在し、オクタペプチド領域や疎水性領域が重要であると考えられた。
また、マウスPrP遺伝子(1)の導入では細胞死抑制が認められるが、ハムスターPrP(9)やウシPrP遺伝子(10)の導入では細胞死抑制が認められなかった。マウス、ハムスター、ウシPrP間ではアミノ酸配列の相違があり、マウス由来細胞株では抑制機能がうまく発揮できないと考えられた。これらの現象を利用していくことによって、PrPの細胞死抑制にもっとも重要なアミノ酸残基の同定が可能となると考えられた。
現在、プリオン蛋白のアポトーシス抑制に関わるアミノ酸領域の同定を進めるとともにプリオン蛋白発現に伴なって変動する遺伝子の検索を進めています。